免疫再構築症候群 診療のポイント Ver.6
| 国立研究開発法人 日本医療研究開発機構(AMED) ART早期化と長期化に伴う日和見感染症への対処に関する研究班 |
![]() PDFファイル:『免疫再構築症候群診療のポイントVer.6』(PDF: 2.6 MB)
PDFファイル:『免疫再構築症候群診療のポイントVer.6』(PDF: 2.6 MB)
免疫再構築症候群(immune reconstitution inflammatory syndrome: IRIS)は抗HIV治療(ART)開始後の免疫能改善により、免疫応答増強による強い炎症反応の結果、隠れていた日和見疾患が顕在化(unmasking)したり、治療経過良好だった日和見疾患が増悪(paradoxical)したりする現象である。日本におけるHIV感染者の新規報告者数は2015年以降から急速な減少傾向となっているが、全報告数の約3割がエイズ発症者であるという「診断の遅れ」は、10年以上に亘って全く改善傾向が見られていないのが現状である。IRIS発症予防や発症後のマネジメントは、今後もHIV診療における重要な問題であり続けるだろうと考えている。
一般的には日和見疾患発症者であっても、多くの場合は早期ART導入が望ましいという点で専門家のコンセンサスが得られている一方で、症例によってはART早期導入を避けるべき状況が存在するのも事実である。例えば、クリプトコックス脳髄膜炎ではARTの早期導入がparadoxical IRIS発症により生命予後が悪化する事から、抗真菌治療を4-6週程度行なってからのART導入が推奨されている。CMV網膜炎症例に十分な抗CMV治療を行なわずにARTを導入すると、paradoxical IRISによる硝子体混濁により急速に失明に至るリスクがある。ニューモシスチス肺炎の重症例における早期ART導入はparadoxical IRISによる呼吸不全再燃や増悪リスクが高い事は、多くの経験ある臨床医が認識している事実である。播種性非結核性抗酸菌症例においてはunmasking / paradoxical IRISが高頻度に起こり、ART継続のためにしばしばステロイドが併用されるが、その投与量や投与期間については明確な指標が存在しない。このようにIRISのマネジメントは難しく、それに関する治験や明確なガイドラインも存在しないのが現状であり、各施設で症例毎に手探りで行なわれているのが現状である。難症例では経験豊富な施設と連携しながらの治療を行なう事が望ましいと思われる。
このような状況を背景に、AMEDエイズ対策実用化研究事業「ART早期化と長期化に伴う日和見感染症への対処に関する研究」班は「IRISの現状と適切なマネジメント」に関する基礎的および臨床的研究を行なってきた。臨床現場における一助となることを期待して、研究成果をまとめた冊子を不定期に作成し、全国のエイズ拠点病院に配布してきたが、本書はその改定版(Ver.6)となっている。
是非ご一読いただき、内容に関する忌憚のないご意見を賜れれば幸いである。本書が臨床現場におけるIRISの疾患理解や診療方針に少しでもお役に立てる事を願っている。
ART早期化と長期化に伴う日和見感染症への対処に関する研究・研究開発代表者国立国際医療研究センター エイズ治療・研究開発センター照屋 勝治
はじめに
近年では、抗HIV治療(ART:antiretroviral therapy)を早期に導入することによってHIV感染症の予後は著明に改善している。しかし診断の遅れなどによって免疫不全がある程度進行してからARTを開始した場合には、時に免疫再構築症候群(IRIS:immune reconstitution inflammatory syndrome)を発症することがある。IRISを発症しても多くの症例は対処が可能で良好な経過をたどるが、時には生命の危機に陥ったり、後遺症を認めることがあるので、その対応を誤らないことは重要である。
2004年に立ち上げられた厚生労働科学研究費補助金エイズ対策研究事業「HAART時代の日和見合併症に関する研究」班(代表研究者:安岡 彰)では、IRISを研究テーマの一つとして取り上げ、その実態調査などを行なっている。2006年にはその成果等を臨床現場に還元する方法として、「“免疫再構築症候群”診療のポイント」を作成し、全国のエイズ診療拠点病院に配布している。その後、研究班は国立研究開発法人日本医療研究開発機構(AMED)「ART早期化と長期化に伴う日和見感染症への対処に関する研究」班(代表研究者:照屋勝治)に引き継がれ、IRISに関する研究も継続している。これまでに「“免疫再構築症候群”診療のポイント」は3年ごとに改訂を行なっており、今年度も「“免疫再構築症候群”診療のポイント Ver.6」を作成したので、各エイズ診療拠点病院にお届けする。
現時点でIRISの全容が解明されている訳ではなく、また時代とともにその実態も変化しているので、本冊子の内容には不十分な点もあるが、先生方の診療に少しでもお役に立てれば幸いと考えている。是非とも「“免疫再構築症候群”診療のポイント Ver.6」に対する忌憚のないご意見をお聞かせいただきたい。
また、本冊子の作成にあたり、さまざまなご協力を賜りました方々に心から感謝する次第である。
ART早期化と長期化に伴う日和見感染症への対処に関する研究・研究開発分担者奈良県立医科大学健康管理センター
古西 満
I.免疫再構築症候群の概念
免疫不全が進行した状態で抗HIV治療を開始した後に、日和見感染症などが発症、再発、再増悪することを経験する。このような現象はzidovudine単剤治療の時代から報告があった 1が、より強力な抗HIV治療が可能になってきた1990年代後半から注目されるようになっている 2。
これは、HIV感染症によって低下した免疫能の回復に伴って発症すると考えられ、「免疫再構築症候群」と呼ばれている。その病態の主体は感染症よりも過剰な炎症が想定されるようになり、当初はimmune reconstitution diseases(IRD)やimmune reconstitution syndrome(IRS)と標記されることが多かったが、今では炎症を含めimmune reconstitution inflammatory syndrome(IRIS)と記されることが多くなっている。
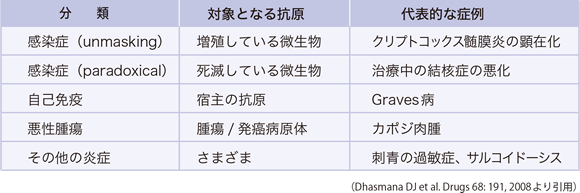
HIV感染者のIRISは過剰な免疫応答の標的となる抗原のタイプによって分類されている 3。感染症-unmaskingは、抗HIV治療開始時に潜在していて診断できていなかった感染症が顕在化するもので、感染症-paradoxicalは、適切な治療を行われたにもかかわらず抗HIV治療後に再増悪するものとされている。自己免疫疾患や悪性腫瘍の発症・増悪やその他の炎症性病態の悪化などに分類されている(表1)。
肺結核の初期悪化は、IRISと類似した病態として指摘されている。初期悪化 4とは、肺結核の治療開始後喀痰中の結核菌は減少あるいは消失しているにもかかわらず、胸部X線写真上陰影の拡大、新規陰影の出現、胸水の出現、リンパ節の腫脹・増大などを認める現象である。これは、初回治療患者にリファンピシン(RFP)を含む抗結核治療を行った際にみられ、急激に死滅した結核菌の菌体に対する局所のアレルギーによると考えられている。近年では、薬物治療を契機とした免疫系のバランスの変化が発症病態に関わっていると考えられる疾患についてもIRISという概念に加える研究者がいる 5。たとえば、関節リウマチに対する生物学的製剤での治療中に肺結核を発症し、薬剤を中止した後に肺結核の増悪を認める場合などが該当する。他には、免疫チェックポイント阻害薬使用時にみられる免疫関連有害事象(immune related adverse event:irAE)や抗けいれん薬などの内服によって生じる重症薬疹の一型である薬剤性過敏症症候群(drug-induced hypersensitivity syndrome:DIHS)などを加えている。
II.免疫再構築症候群 の発症機序
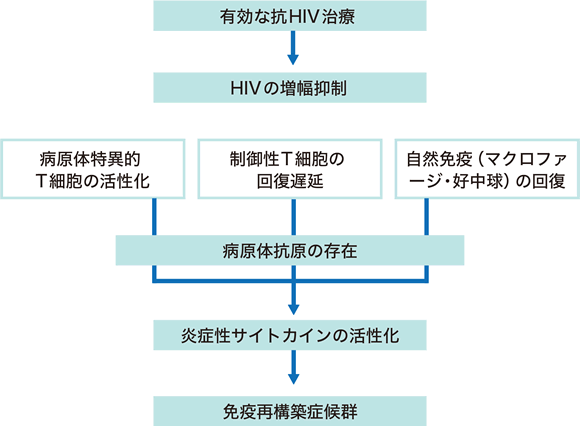
HIV感染は免疫系に量的および質的なダメージを与え、無治療であれば免疫不全を生じさせる。ところが、有効な抗HIV治療を行うと1~2週間以内に体内のウイルス量が90%以上減少し、このウイルス量の減少に反比例するように免疫細胞の回復がみられる。典型的なCD4陽性Tリンパ球の回復は二相性である。初期の2~3ヵ月間には、主にリンパ組織に存在する活性化されたメモリーT細胞(CD4+CD45RO+)が再配分され 6、リンパ球のアポトーシスが減少することと相まってCD4陽性Tリンパ球が増加する。その後は、主にナイーブT細胞がゆっくりと回復してくる。IRISはどちらの時期にも発症し得るが、抗酸菌症などの感染症によるIRISは初期の相で発症しやすく 7、Graves病のような非感染症のIRISは後期の相で発症する傾向があると言われている。
抗HIV治療開始後CD8陽性Tリンパ球は速やかに増加し、HIV感染症により機能不全に陥っていた単球・マクロファージ・NK細胞などの機能も回復する。これらのCD4陽性Tリンパ球数・CD8陽性Tリンパ球数の劇的な回復が、細胞性免疫・液性免疫の急速な改善をもたらす。その一方で制御性T細胞の機能回復は遅れるため、体内に存在する病原微生物などの抗原に対する免疫応答が過剰に誘導されてIRISを発症するのではないかと考えられている 8(図1)。
Kitabatakeら 9は、肺Mycobacterium avium complex(MAC)感染症のIRISマウスモデルを作製し、その病態を解析している。マウスモデルではCD4陽性Tリンパ球が回復する際にTh1細胞、Th17細胞は正常に誘導されるが、制御性T細胞の分化・誘導が低下している。その結果、CD8陽性Tリンパ球の過剰な活性化が肺MAC感染症に対する異常な炎症を惹起している(図2)ことを報告している。
他にTh1/Th2バランスの変化、アポトーシス過程での変調、遺伝学的な感受性、病原体等の抗原量などがIRISの発症機序に関与するのではないかと考えられている 3。しかし、IRISの発症機序は、未だに全容の解明には至っていない。また、IRISの病状は多彩であり、全てが同一の発症機序で説明できない可能性もあるので、今後の詳細な研究成果を待つ必要がある。
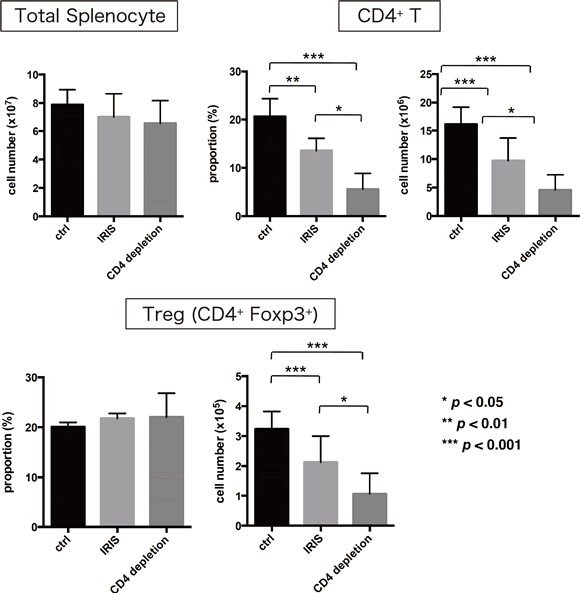
図2:Mycobacterium avium complex-免疫再構築症候群マウスモデルの解析結果
III. 免疫再構築症候群の診断
IRISを診断するための有用なバイオマーカーなどが見出されておらず、未だに確定した診断基準は存在しない。Shelburneら 10が提案したIRISの診断基準(表2)は、IRISの概念を理解する上で優れた診断基準ではあるが、4番目の「上記症候は新たな感染症、既に認識されている感染症の予測されうる臨床経過や治療の副作用では説明できない」という項目を臨床的に確定することは意外に困難な場合もある。Haddowら 11は、paradoxical IRISとunmasking IRISを分けた診断基準(表3)を発表しているが、除外診断の域から脱することはできていない。Suryana 12が結核症によるparadoxical IRISの診断の流れを解説しており、臨床診断を行う際の参考になる。今後の経験や研究成果の集積によって、より精度の高い診断法が確立されることが望まれる。
表3: Haddowらによる免疫再構築症候群の診断基準 (2009) 
IRISとして認識されている疾患は感染症のみではなく、自己免疫性疾患、悪性腫瘍、炎症性病態などに分類されるさまざまな疾患がIRISとして報告されている 3, 13(表4)。しかし、前述したように今はIRISの診断に役立つバイオマーカーが存在しないので、現在IRISとして報告されている疾患の全てが、将来的にもIRISと診断される訳ではないことを承知しておく必要がある。
そこで、現時点では免疫不全のあるHIV感染者に対して新規に抗HIV治療を開始、中断中の抗HIV治療の再開、もしくは効果不十分な治療を有効な抗HIV治療に変更後、数ヵ月以内に日和見感染症などの疾患が発症、再発、再増悪した場合には、IRISを鑑別診断の上位に据えながら対応していくことが妥当ではないかと考える。この際も、抗HIV治療が有効であることを確認すること(血中HIV-RNA量の低下)や抗HIV治療や日和見疾患治療などの副作用を除外することは必要である。しかし、Graves病(甲状腺機能亢進症)などの一部のIRISでは、抗HIV治療開始12~36ヵ月以降に発症する 14ことが指摘されており、注意しなければならない。遅れて発症するIRISの疾患は免疫再構築の後期相で発症しており、発症機序的には自己免疫性疾患では起こり得るのではないかと考えられる。ところが、当初は我々が研究班で実施した調査結果 15や海外からの帯状疱疹-IRISの疫学研究結果 16などで、抗HIV治療開始半年以上の経過後に発症した疾患をIRISとして集計に加えていたことがあったが、現時点では、半年以上経過後に発症した疾患(特に感染症の場合)はIRISの可能性が低くなるものと考えておく方が良い。
IV. 免疫再構築症候群の発症に関連するリスク因子
IRISの発症リスクを評価した上で抗HIV治療を開始できることは、その後のHIV感染者のメネジメントにとって有益である。
そのため我々は、厚生労働省「HAART時代の日和見合併症に関する研究」班(主任研究者:安岡 彰)においてIRISの発症リスクを分析している 14。IRIS発症者66名と未発症者162名の臨床情報を比較し、IRIS発症に関連する臨床指標を抽出している。単変量解析結果では、IRIS発症者は①年齢が高く、②AIDS発症例が多く、③抗HIV治療開始前のCD4陽性Tリンパ球数、CD8陽性Tリンパ球数がともに低く、HIV-RNA量が高く、④抗HIV治療開始前のヘモグロビン値が低く、⑤抗HIV治療開始1ヵ月後のCD4陽性細胞数の増加率が高いことが明らかになっている(表5)。
表5:免疫再構築症候群発症に関連する臨床指標(単変量解析結果)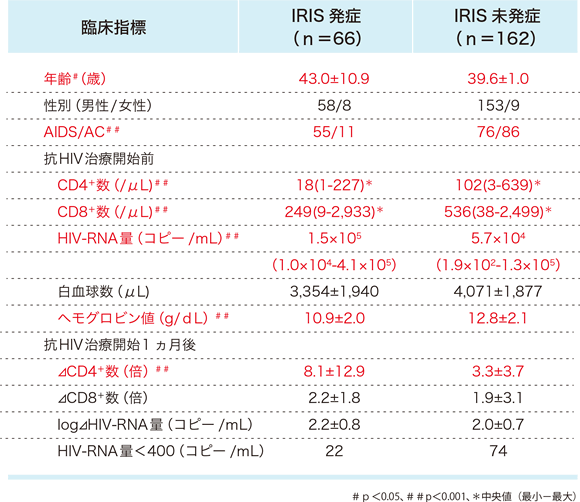
多変量解析(ロジスティック解析)を行うと、①抗HIV治療開始前のCD4陽性Tリンパ球数が50/μL未満、②抗HIV治療開始前のHIV-RNA量が1.0×10 5コピー/mL以上の2項目がIRIS発症と関連する有意な臨床指標であった(表6)。Frenchら 17もIRISを起こした症例は起こしていない症例に比べ、抗HIV治療開始時のCD4陽性Tリンパ球数(88 vs 237/μL、P=0.0001)とHIV-RNA量(5.36 vs 4.88 log10コピー/mL、P=0.007)とに有意差を認めたと報告している。Müllerrら 18は、21研究のメタ回帰解析で抗HIV治療開始時のCD4陽性Tリンパ球数中央値とIRIS発症率について分析し、事前の日和見疾患とは関係なくCD4陽性Tリンパ球数が低いほどIRIS発症率が高くなると指摘している(図3)。したがって、抗HIV治療開始前のCD4陽性Tリンパ球数が低値(50/μL以下)、HIV RNA量が高値(10万コピー/mL以上)の症例については、IRISの発症にも注意しながら抗HIV治療後の経過を観察していく必要度が高いと考える。
表6:免疫再構築症候群発症に関連する臨床指標(多変量解析結果)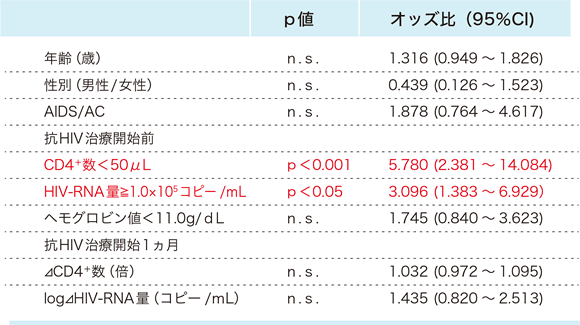
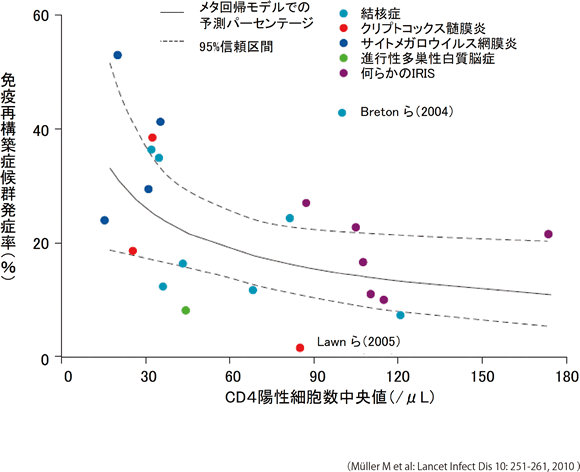
図3:抗HIV治療開始時のCD4 陽性Tリンパ球数による免疫再構築症候群発症率
Walkerら 13の総説に記載されているIRIS発症に関連する危険因子は表7に示すように多岐にわたっているので、総合的にリスク評価を行わなければならない。今後の研究成果によってIRIS発症に関連する危険因子は変更、追加される可能性があるので、新たな情報を確認する必要がある。
現在の抗HIV治療のキードラッグは、わが国においてもインテグラーゼ阻害薬が主流となっている。インテグラーゼ阻害薬をベースとする抗HIV治療では入院を要する重篤なIRISを発症するリスクが高いという報告 19や入院率や死亡率を増やすことはないがIRISの発症リスク(オッズ比 2.43、95%CI:1.45-4.07)であるという報告 20が散見される。これらの報告結果は、インテグラーゼ阻害薬の持つ強力な抗HIV活性が影響している可能性があるが、いずれも後方視的研究であるので薬剤選択時にバイアスがかかっている可能性は否定できない。一方、Kityoら 21は、キードラッグをラルテグラビルと非核酸系逆転写酵素阻害薬の2群に分け比較した無作為試験ではIRISの発症率に有意差を認めなかったと報告している。その後もインテグラーゼ阻害薬がIRISの発症リスクであるという報告とそうではないという報告とがあり、まだ確定的な結論には至っていない 22-24。抗HIV治療の選択薬剤がIRIS発症のリスクに関連するのかどうかは今後のデータ集積を待つ必要があると考える。
V. 免疫再構築症候群の疫学
1)発症率
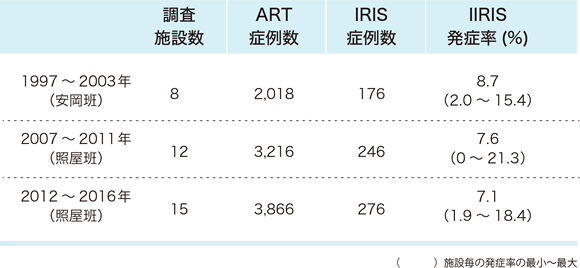
我々は、厚生労働省「HAART時代の日和見合併症に関する研究」班(主任研究者:安岡 彰)において、1997~2003年に抗HIV治療を受けた症例でのIRISの発症率・発症疾患に関する多施設調査を実施した。この時は8施設からの回答を集計し、2,018例中176例(8.7%)にIRISを発症していた。その後、日本医療研究開発機構(AMED)「ART早期化と長期化に伴う日和見感染症への対処に関する研究」班(代表研究者:照屋勝治)において2007~2011年および2012~2016年に抗HIV治療を受けた症例でのIRISの発症率・発症疾患に関する多施設調査を2回実施した。2回目調査は12施設・3,216例中246例(7.6%)、3回目調査は15施設・3,866例中276例(7.1%)であり、IRIS発症率は徐々に低下傾向にあった 22(表8)。
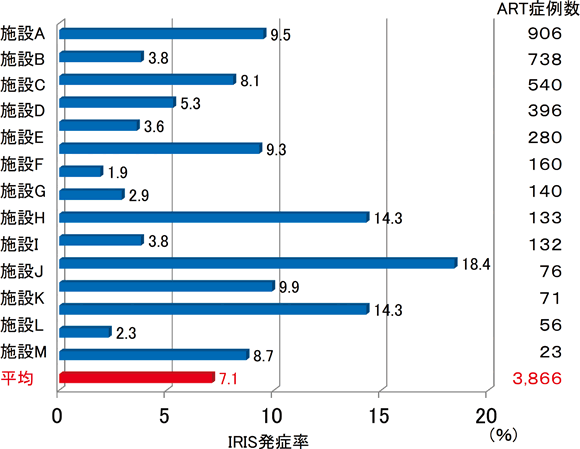
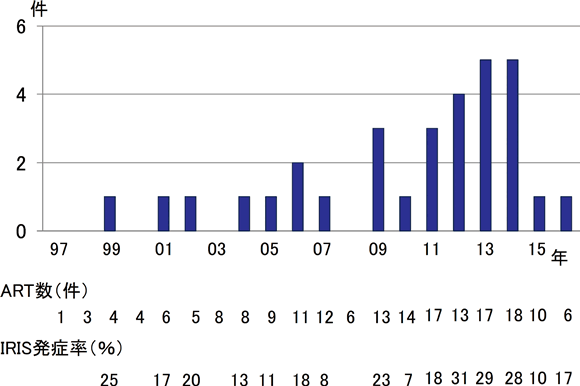
調査した施設全体でみるとIRISの発症率は7~8%台で推移しているが、施設ごとの発症率には差がある。たとえば、3回目調査では15施設間のIRIS発症率は1.9~18.4%と10倍ほどの差を認めている(図4)。これは、施設ごとでの集計にすれば対象症例数が少なくなるため、1例のIRIS発症が発症率に大きく影響することによるが、それ以外にも各施設で診療している症例背景の違い(AIDS発症症例比率など)、抗HIV治療の導入時期に対する考え方の差(早期導入に積極的か消極的か)などもIRIS発症率に影響していると考えられる。例えば、日和見感染症を起こした症例に限ってIRISの発症率をみると、2~63%と高率になる 18, 26-32。図5には奈良県立医科大学における1997~2016年の20年間のIRIS発症件数・発症率を示す。20年間のIRIS発症率は15.7%であるが、年次ごとの発症率には大きな差があり 35、1施設だけでIRIS発症率を把握していくことには限界があり、多施設調査を継続することは重要である。
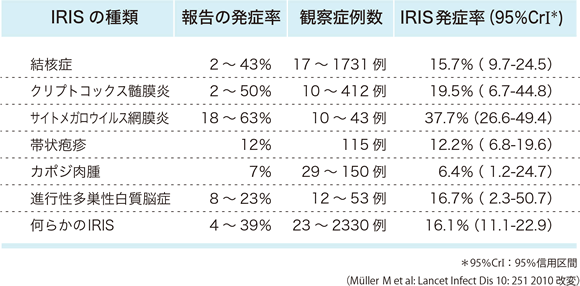
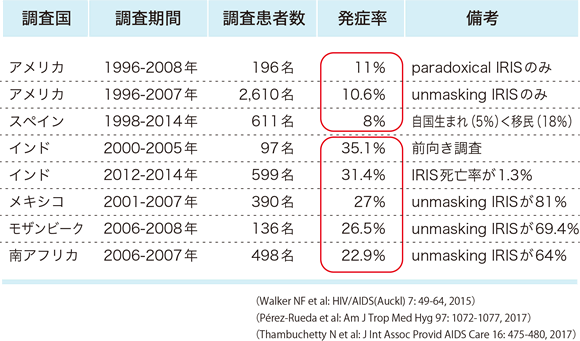
Müllerら 18による54のコホート研究のメタ解析結果から、抗HIV治療を開始した患者13,103名中1,699名(13.0%)にIRISを発症したと報告している。また、IRISの発症疾患を結核症、クリプトコックス髄膜炎、サイトメガロウイルス網膜炎、帯状疱疹、カポジ肉腫、進行性多巣性白質脳症、何らかのIRISに分けて、それぞれの発症率を解析している。その結果は表9に示す通りであり、発症疾患によって発症率に差を認めるので抗HIV治療導入時には意識しておくべき点になると考える。IRIS発症率に関する報告の多くは、後方視的研究である。Murdochら 27は、CD4陽性細胞数が200/μL未満である症例かAIDSを発症した症例に初回抗HIV治療を導入し、IRIS発症率に関する前向き研究を実施している。その結果、6ヵ月以内にIRISを発症した症例は423例中44例(10.4%)であったと報告している。次に国別のIRIS発症率をみると、調査期間、調査患者数など違いがあり単純には比較することはできないが、先進国に比べて途上国でIRIS発症率が高いことがわかる 13, 34, 35(表10)。これは国ごとに流行している感染症や罹患しやすい疾患、医療体制などに違いがあり、IRIS発症率に影響を及ぼしている可能性が推察される。そのため、抗HIV治療を開始する際にはHIV感染者の出身国・滞在国の情報も把握しておくことは重要である。
2)発症疾患
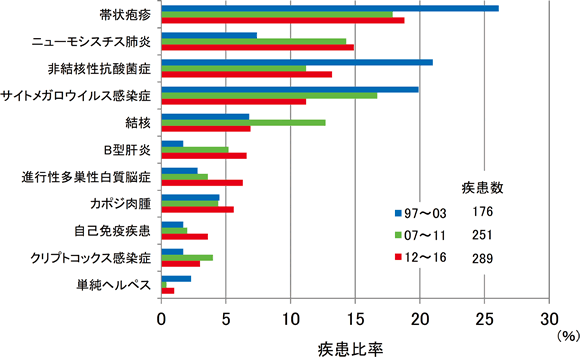
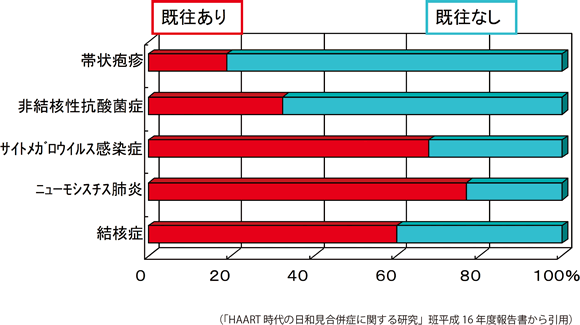
前述したようにIRISと診断される疾患は多彩で、研究班の多施設調査でもさまざまな疾患が集計され、3回目調査では28疾患となっている。しかし、1回目から3回目の調査とも上位の疾患は帯状疱疹、非結核性抗酸菌症、サイトメガロウイルス感染症、ニューモシスチス肺炎、結核症の5疾患である(図6)。1回目調査の結果では、帯状疱疹、非結核性抗酸菌症はunmasking IRISの方が多く、サイトメガロウイルス感染症、ニューモシスチス肺炎、結核症はparadoxical IRISの方が多い傾向を認めている。Lodi ら 36は、欧米でのunmasking IRISの発症を把握するため抗HIV治療の有無で日和見疾患の発症率を分析している。その結果、先進国では結核症、非結核性抗酸菌症以外の疾患ではunmasking IRIS は一般的ではないと述べている。研究班による3回の調査から発症率の変化を比較してみると、B型肝炎、進行性多巣性白質脳症、自己免疫疾患が増加傾向を認めている(図6)。これからもIRISの発症疾患は変化していく可能性があり、今後の動向に注意しておく必要がある。またSeretiら 37は、アメリカ、タイ、ケニアの3ヵ国でCD4陽性細胞数が100/μLのHIV感染者に発症したIRISを前方視的に調査し、発症疾患には違いがあったと報告している。したがって、前述したように抗HIV治療の導入時にはHIV感染者の出身国・滞在国の情報も意識して経過をみることは重要であると考える。
VI. 免疫再構築症候群への対応
IRISを予防する方法やIRIS発症時の対処方法は少しずつ集積されてきているが、未だに全てが確立したものとはなっていない。以下には、これまでのエビデンスや経験から考えられる対応方法について述べる。
1)抗HIV治療開始前の対応
抗HIV治療開始前には、日和見合併症の有無を評価しておくことが重要である。有症状時には見逃すことは少ないと思われるが、IRISとして認める疾患は必ずしも事前に把握できていないこと 15(図7)、免疫不全が進行したHIV感染者では同時に複数の合併症を認めることがあるので、注意が必要である。胸部画像でみられた結節影が肺非結核性抗酸菌症や肺クリプトコックス症だと後日判明する症例を時に経験する。そのため、免疫不全が進行した症例、特にCD4陽性細胞数が50/μL未満の症例では、抗HIV治療開始前に眼底検査、胸・腹部CT、脳MRI、血液検査としてβ-Dグルカン、クリプトコックス抗原、サイトメガロウイルス抗原およびインターフェロンγ遊離試験(IGRA)などの検査ができていると良い。
Elliottら 38は抗HIV治療開始前にIGRAが陽性である場合には結核症のunmasking IRIS発症の予測に役立つと報告し、Jarvisら 39は抗HIV治療開始2週以内の実施した血漿クリプトコックス抗原が陰性の場合には1年はクリプトコックス髄膜炎の発症がなかったと報告しており、HIV治療開始前の検査の有用性が示されている。
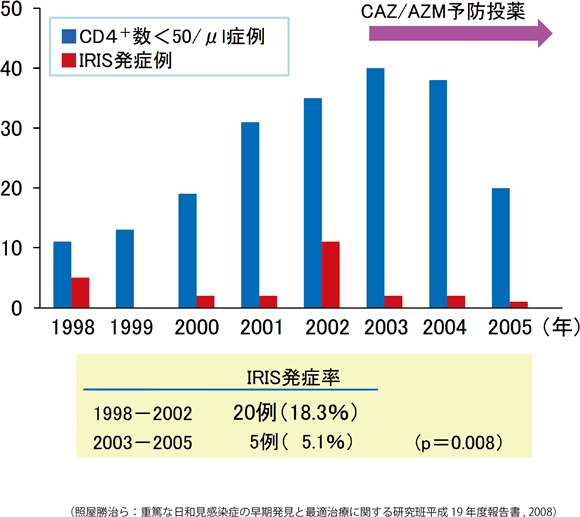
体内の病原体抗原量が多いことは、IRIS発症リスクの一つとされている(表7)。照屋ら 40は、CD4陽性細胞数50/μL未満の症例に抗HIV治療開始前にクラリスロマイシンまたはアジスロマイシンによる予防を実施することでMAC感染症のIRIS発症が減少したことを報告している(図8)。日和見感染症を未発症の場合でもCD4陽性細胞数が50/μL未満で抗HIV治療を開始していない症例にはMAC感染症、200/μL未満の症例にはニューモシスチス肺炎の一次予防が推奨されている 41。
また、一方でIRISの予防法に関わる試みが始められている。Meintjesら 42は、結核によるparadoxical IRISに対するプレドニゾロンの予防効果を無作為二重盲検試験(対照はプラセボ)で評価している。CD4陽性細胞数が100/μL未満で、有効な抗結核治療開始後30日以内に抗HIV治療を開始するナイーブ症例を対象としている。プレドニゾロンは抗HIV治療開始48時間以内に始め、40mg/日を14日、20mg/日を14日投与する。IRISの累積発生率はプレドニゾロン群が32.5%、プラセボ群が46.7%で、相対リスクは0.70(95% CI:0.51-0.96、p=0.03)と予防効果を認め、重篤な副反応や感染症発症もみられなかったと報告している。今後の追試験結果などをふまえて、結核症によるparadoxical IRISの予防法として定着するのかは注視しておく必要がある。
しかし、IRIS発症を抑制するためには、HIV感染症を早期に診断して、免疫不全が進行しない早期に抗HIV治療を開始することが最も有効な方法であると考える。
2)日和見合併症発症例に対する抗HIV治療の開始時期
抗HIV治療開始前に発症した日和見合併症の治療後、いつから抗HIV治療を導入するかについてはまだ議論されているところではある。IRIS発症を回避するためには、体内の病原体の抗原量を十分に減らしてから抗HIV治療を開始することが望ましい。しかし、免疫不全が進行した症例で抗HIV治療開始を遅らせると新たな日和見合併症の発症リスクなどがあり、悩ましい問題である 8。
Lawnら 43はCD4陽性細胞数が100/μL未満で結核症を合併した症例では、抗結核治療開始後早期に抗HIV治療を開始するほどIRISの発症率が高いと報告している。照屋ら(図9)。照屋ら 44は、ニューモシスチス肺炎治療から抗HIV治療開始までの期間が短いとIRISの発症率が高く、抗HIV治療開始が遅くなるとニューモシスチス肺炎以外の日和見合併症を発症することが多くなると報告している(表11)。
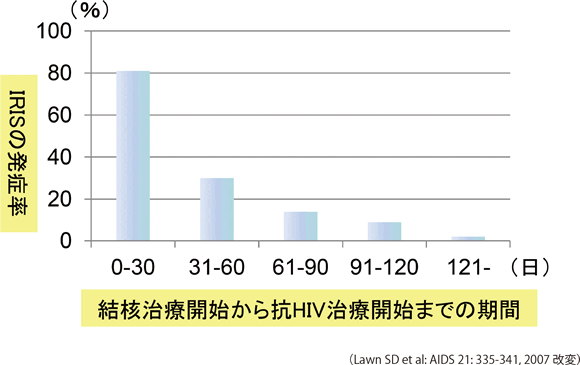
図9:免疫再構築症候群発症と結核治療から抗HIV治療開始期間の関係
表11:ニューモシスチス肺炎治療からART開始までの期間と免疫再構築症候群および日和見疾患の発症頻度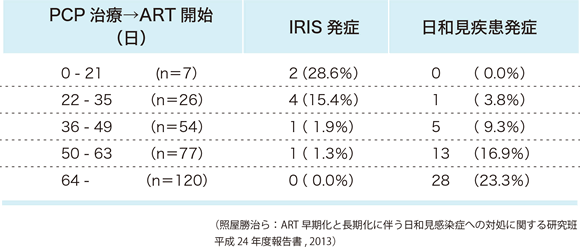
一方で、海外からは日和見感染症発症後も早期に抗HIV治療を開始することの意義が報告されている。Zolopaら 45は、日和見感染症治療開始後14日以内に抗HIV治療を開始する早期導入群の方が抗HIV治療を遅らせて始める群に比べ、新たなAIDS指標疾患の発症や全体の死亡が有意に少なく、IRISの発症率には差がないと報告している(ACTG A5164 study)。Abayら 46は、結核合併AIDS症例の抗HIV治療開始時期に関する6つの臨床試験をメタ解析し、抗結核治療開始後早期に抗HIV治療を始めることでIRISの発症率は高くなるが、全死亡を有意に減少させ、特にその傾向はCD4陽性細胞数が50/μL未満症例で顕著であることを報告している(表12)。ところが、Liら 47は10件の臨床試験結果のメタ解析から抗結核治療開始後早期に抗HIV治療を始めることでIRISの発症率は高くなるが、死亡率の減少には差がないと報告している。クリプトコックス髄膜炎合併AIDS症例では、Makadzangeら 48が早期に抗HIV療法を導入すると死亡率が高く、生存期間が短いと報告し、その原因としてIRIS発症の関与を考察している。Boulwareら 49は抗HIV治療早期群と待機群でIRISの発症率には有意差はないが、26週までの死亡率は早期群の方が有意に高いと報告している(表13)。クリプトコックス髄膜炎症例における抗HIV治療導入時期についてのシステマティックレビューでは、診断後4週以内の抗HIV治療導入群では死亡リスクが高いが、IRISがその要因であるかは明確にはなっていない 50。2019年にはトキソプラズマ症とニューモシスチス肺炎発症例を対象にした無作為・前向き研究が報告され、日和見感染症治療開始後7日以内に抗HIV治療を開始する早期導入群と日和見感染症治療終了後に抗HIV治療を開始する待機群ではIRISや他の合併症の発症率、免疫学的およびウイルス学的治療効果に有意差はないと記されている 50。
DHHSガイドライン 41では、結核症でCD4陽性細胞数が50/μL未満の場合は結核治療後2週以内に抗HIV治療を開始することを強く推奨し、50/μL以上の場合は8週以内に抗HIV治療を開始することを勧めている。また、IAS-USA Panelガイドラインでも日和見感染症合併症例ではできれば2週以内の早期に抗HIV治療を導入することを勧め、結核合併症例についてはDHHSガイドラインとほぼ同様の内容となっている。ただし、クリプトコックス髄膜炎、結核性髄膜炎の症例では慎重に対応することが記載されている 52。表14には、米国の日和見感染症ガイドライン 53に記載されている主な合併症発症時の抗HIV治療開始時期を示すが、まだ推奨レベルの低いものもあるので今後のエビデンスの集積が待たれる。また、TEMPRANO試験 54やSTART試験 55では、CD4陽性細胞数が500/μL超のHIV感染者を対象として抗HIV療法を早期実施群と待機群に分け活動性結核の発症を比較したところ、早期実施群が待機群より結核発症が抑制されたことを報告している。早期の抗HIV療法導入は、CD4陽性細胞数が高くても起こる合併症の発症を予防する効果があることを示唆するもので、IRISの予防にも有利にはたらくと思われる。
表12:結核治療と ART開始時期に関する比較試験のメタ解析結果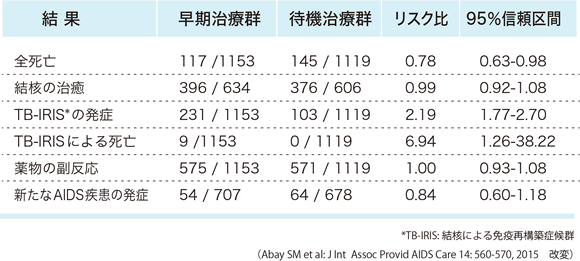
表13:日和見感染症治療と抗 HIV治療開始時期に関する比較試験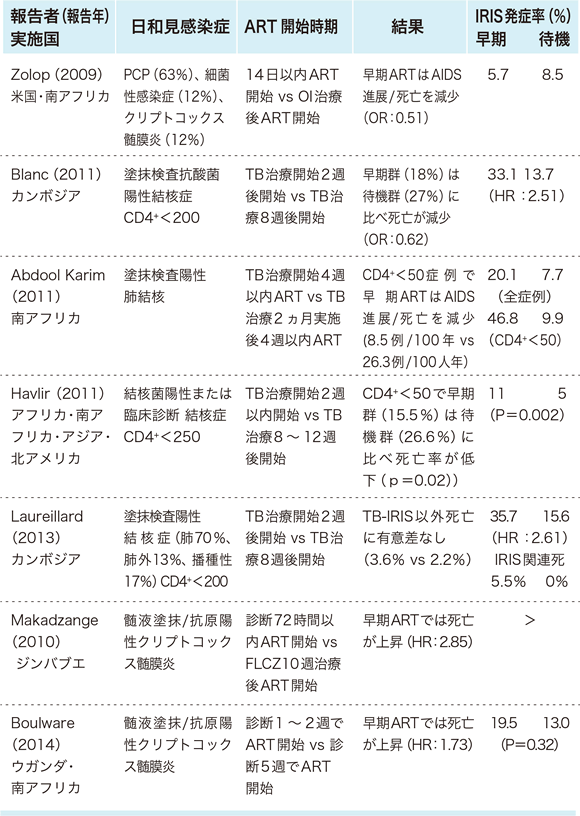
日和見合併症治療後の抗HIV治療開始時期は早期導入が推奨される傾向にあるが、当然ケースバイケースで考えることになる。実臨床では、推奨期間に抗HIV治療を開始することが困難なことも多い。渡邉ら 56はCD4陽性細胞数が50/μL未満のHIV感染症合併結核患者18例で2週以内に抗HIV治療を開始できた症例は3例(16%)であったが、抗HIV治療が遅れても予後への影響は少なかったと報告している。また抗HIV治療が遅れる原因は抗結核薬の副作用が最も多かったと指摘している。したがって、わが国での対応としては抗HIV治療開始が待てそうな症例ではニューモシスチス肺炎、サイトメガロウイルス感染症の場合は3週間の治療終了後、非結核性抗酸菌症、結核症の場合は1~2カ月間の治療後に抗HIV治療を開始したり、開始せざる得ないことが多い傾向にある。
研究班では、CD4陽性細胞数が50/μL未満の症例で日和見疾患が合併した場合に日和見疾患治療開始後の抗HIV治療導入時期についての考え方をHIV診療医に調査してきている。2017年の調査結果でも、わが国のHIV診療医は日和見感染症の病状が安定した後に抗HIV治療を開始する傾向にあるが、2週以内を治療開始時期であると考える者も増えてきている(図10)。
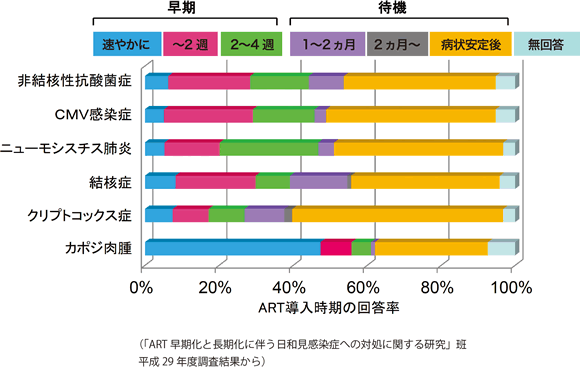
図10:HIV診療医 93名の抗 HIV治療導入時期に関する考え方
一方、進行性多巣性白質脳症やカポジ肉腫などでは、早期に抗HIV治療を導入することが推奨されている。しかし、進行性多巣性白質脳症ではIRISが起こり易いので、副腎皮質ステロイド薬を併用しながら抗HIV治療を開始する試みが始められている 57。Tanら 58は進行性多巣性白質脳症のIRISでは副腎皮質ステロイド薬を早期に開始し、緩徐に減量することが有用であると報告している。また、中枢気道にカポジ肉腫病変が存在する症例ではIRISを発症した場合致死的な危険性を生じる可能性もあり、抗がん化学療法を先行させるなどの慎重な判断が求められる 59。
現時点では日和見感染症の感染臓器、重症度、免疫不全の程度、治療による副作用の有無、薬物相互作用、アドヒアランス、IRISを発症した場合の重篤度の予想、副腎皮質ステロイド薬による予防の可能性などを勘案し、可能な範囲で早期に抗HIV治療を導入することが望ましい。
3)免疫再構築症候群への対処
IRISを発症した場合も、有効な抗HIV治療をできる限り継続して対応することが基本である。Stollら 60は、HIV感染者で炎症性病態が増悪した場合の考え方、対応をフローチャートにして示している(図11)。
IRISへの対処方法には、その疾患自身に対する治療と過剰な炎症のコントロールとがある。疾患が感染症である場合には、病原体の増殖がなければ、抗微生物薬の投与は不要とする考え方もある 61。しかし、臨床的に病原体の増殖がないことの証明は難しいこともあり、IRISの病態が軽症で経過をみられる場合を除けば、抗微生物薬の継続や開始が必要であり、治療経過によっては抗微生物薬の追加・変更を考慮する場合もある。炎症のコントロールの方法には、NSAIDsや副腎皮質ステロイド薬 62の投与がある。副腎皮質ステロイド薬は、臓器の機能障害が重篤な場合、生命の危機がある場合、他の方法が無効な場合などに考慮する。副腎皮質ステロイド薬の投与方法は決まってはいないが、プレドニゾロン1~2mg/kg/日相当で開始して1~2週間継続後に週から月単位で減量する方法などがある 62,63。時に副腎皮質ステロイド薬に不応性のIRISや難治性のIRISを経験することがあり、その対応は今後の大きな課題である。症例報告レベルではあるが、結核症によるIRISに対する副腎皮質ステロイド薬以外での治療について報告されており、今後わが国においても副腎皮質ステロイド薬だけでは対処できないIRIS症例の治療法として参考になる 64(表15)。
時にIRISのため抗HIV治療を中止せざる得ないこともあるが、その基準もはっきりとは決まっていない。現時点では、抗HIV治療を継続することでIRISの病態が生命を脅かす場合や副腎皮質ステロイド薬などの治療が無効な場合などに、抗HIV治療の中止を考慮する。
表15:結核症 -IRISに用いられた副腎皮質ステロイド薬以外の薬剤を使用した症例報告例
Haddowら 65は抗HIV治療を開始した成人498名を24週間フォローする前向き調査を実施したところ、114名(22.9%)でIRISを発症している。フォロー期間の死亡例25名中6名(24%)、抗HIV治療薬の変更・中断例35名中10名(29%)、入院例65名中13名(20%)はIRISが原因であった(図12)と報告している。古い検討ではあるが、IRISが入院、抗HIV治療の中断や死亡につながることもあるので、そのマネジメントは臨床上重要な課題となる。
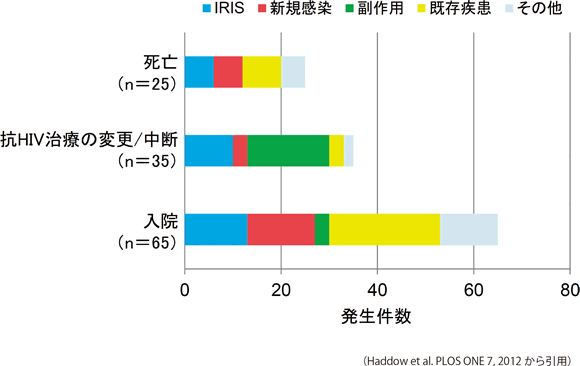
図12:抗HIV治療後24週以内にみられた有害事象とその原因
VII. 主な免疫再構築症候群の疾患
わが国で頻度の高い免疫再構築症候群としての疾患は、帯状疱疹、非結核性抗酸菌症、サイトメガロウイルス感染症、ニューモシスチス肺炎、結核症などであり、最近ではB型肝炎、進行性多巣性白質脳症や自己免疫疾患が増加傾向を示している(図6)。
以下には、厚生労働省「HAART時代の日和見合併症に関する研究」班(主任研究者:安岡 彰)の調査結果 15等を含めて、主な疾患の臨床像などについて紹介する。
1)帯状疱疹
帯状疱疹は、他の日和見疾患に比べてCD4陽性細胞数が比較的高い症例でも発症することがある。強力な抗HIV治療が可能になり、HIV感染者での帯状疱疹の発症率は減少しているが、未だにHIV非感染者よりも3倍の発症率を示している。抗HIV治療導入後6ヵ月以内の方が6ヵ月以降よりも帯状疱疹の発症率は高く 66、これは抗HIV治療開始後早期の帯状疱疹発症にはIRISが関与しているものと推察される。
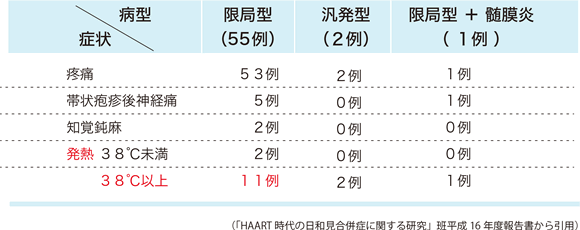
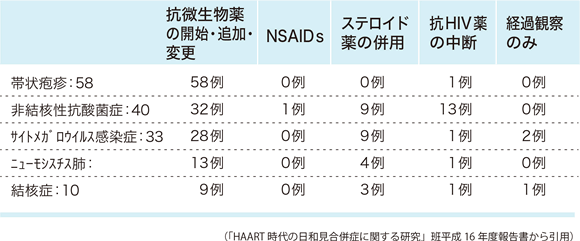
研究班の調査では、帯状疱疹-IRISの病型は59例中56例が限局型皮膚病変であるが、2例が汎発型、1例が限局型に髄膜炎を合併しており、時に重症型の帯状疱疹となることがある(表16)。また、角膜炎、ぶどう膜炎や急性網膜壊死 67等の眼病変、脳神経麻痺 68、脳血管炎 69などの特殊な病型を呈することもあるので、注意が必要である。限局型皮膚病変の臨床症状は一般の帯状疱疹と類似しているが、約20%の症例で38℃以上の発熱を伴っていた点はIRISに特徴的であるのかもしれない。帯状疱疹後神経痛を6例に認めているが、文献的には帯状疱疹後神経痛の発症率にはHIV非感染者と差がなく、高齢者ほど発症しやすい 70と記載されている。
IRISであっても皮膚病変のみの場合は、抗ヘルペスウイルス薬の内服治療で対応できる。病状に応じて抗ヘルペスウイルス薬の点滴投与、副腎皮質ステロイド薬の併用が必要となり、眼病変の場合は眼科医による専門的な診療が強く推奨されている 53。
2)非結核性抗酸菌症
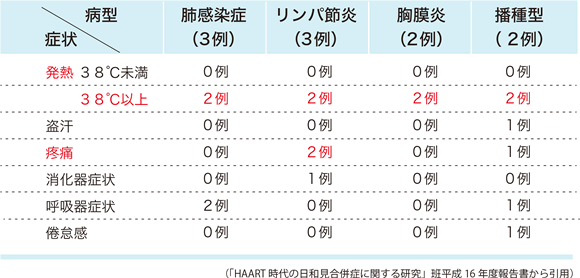
平成16年度の研究班による調査では、非結核性抗酸菌症の病型は、播種型、リンパ節炎型、肺感染症型がほぼ同頻度で認められている。HIV感染者に日和見感染症として発症するMAC感染症は播種型やリンパ節炎型が多い印象があるが、非結核性抗酸菌症によるIRISでは肺感染症型の頻度も高いことは、知っておく必要がある。播種型・リンパ節炎型では、38℃以上の発熱があり、播種型の1/3の症例で消化器症状、リンパ節炎型の半数の症例で疼痛を伴っている。肺感染症型の1/2の症例では自覚症状が乏しく、胸部画像検査が重要である(表17)。菌種が同定できた症例では、1例がMycobacterium kansasii、他の症例はMACであった。しかし、ケースレポートとしてさまざまな菌種による非結核性抗酸菌症-IRISが報告されている 71, 72ので、治療法の選択にも影響があることから菌種の同定に努める必要がある。HIV非感染者の肺MAC感染症の診断には、抗GPL core IgA抗体(キャピリアMAC抗体)が有用である 73が、照屋らはHIV感染者に発症したMAC感染症では陽性になることが少ないと報告している。
表17:免疫再構築症候群としての非結核性抗酸菌症の病型・症状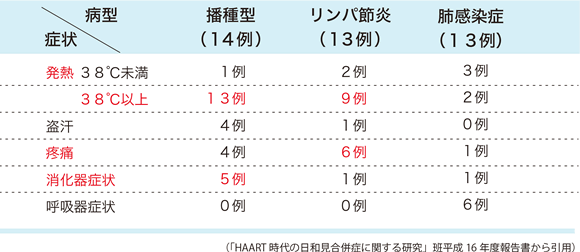
このように非結核性抗酸菌症によるIRISはMAC感染症が大半であるので、研究班ではMAC-IRISのみについて再度調査を行った 74ところ、60例の病型は、播種型(18例)、リンパ節炎型(19例)、肺感染症型(17例)がほぼ同頻度で消化管型(4例)がわずかに存在することが示されている。ケースレポートでは、壊死性皮下結節、骨髄炎、滑液包炎、肉芽腫性肝炎、脊椎傍膿瘍、脳膿瘍などさまざまなMAC-IRIS症例が報告されているので、適確な診断が求められる。抗HIV治療開始からIRIS発症までの期間は、中央値が19.5日で、70%の症例が30日以内、88%の症例が90日以内である(図13)。このことからも6ヵ月以上を経過して発症する場合には、IRISと診断してよいのかは慎重に判断する必要があると考える。IRIS発症時のCD4陽性細胞数は、抗HIV治療開始前の22/μLから111/μLに増加しており、42%の症例はIRISの対応に副腎皮質ステロイド薬の投与が必要な病状である。Ridellら 75は20例のMAC-IRIS症例を集計し、報告しているが、病型の内訳に差がある以外その他の項目はほぼ研究班の調査結果と同様の結果であり、興味深いところである。また、MAC-IRIS症例ではリンパ節炎型を中心に23%で副腎皮質ステロイド薬を2年以上にわたる長期間継続する必要があり、難治化傾向を認めている(表18)。
疫学の項でも述べたように非結核性抗酸菌症によるIRISはunmasking IRISとして発症することが多く、Breglioら 76もMAC-IRIS症例17例中12例がunmasking IRISで、そのうち7例が肺感染症型であったと報告している。CD4陽性細胞数が50/μL未満の症例で抗HIV治療を開始する際には、非結核性抗酸菌症によるunmasking IRISの発症リスクを頭の片隅に置きながら経過をみる必要がある。また、MAC-IRIS症例の多くは他の日和見疾患を同時に有していることを指摘しており、注意すべき点である。
MAC-IRISに対しても抗菌化学療法が必要であり、治療中であれば継続し、無治療であれば開始することが望ましい。MACに対する治療は、クラリスロマイシンまたはアジスロマイシンにエタンブトールを加えた方法が基本となる 77。発熱や疼痛に対してはNSAIDsによる対症療法を行うが、改善が乏しい場合には副腎皮質ステロイド薬を使用する。プレドニゾロンを0.5~1mg/kg/日で開始し、経過をみながら減量していく。前述したように40%ほどの症例では副腎皮質ステロイド薬が必要となるので、躊躇せず開始することが重要である。時には腫大したリンパ節などの切除や膿瘍ドレナージなど外科的な処置が必要となることもある。
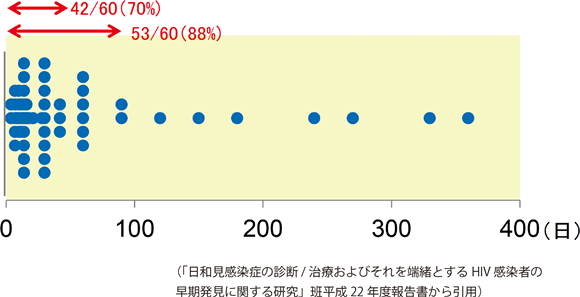
図13:抗 HIV治療開始から MAC-IRIS発症までの期間
表18:MAC-IRISに関する研究班調査結果と Riddellらの報告との比較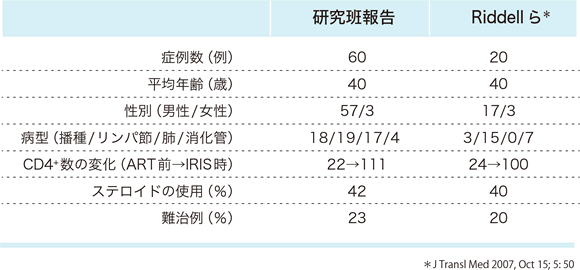
3)結核症
研究班の調査結果では、結核症の病型は肺感染症型、リンパ節炎型、播種型、胸膜炎型が同頻度で認めている。いずれの病型でも38℃以上の発熱を認めることが多く、リンパ節炎型では非結核性抗酸菌症のIRISと同様に疼痛を伴うことが多い(表19)。結核症の診断は、10例中5例は臨床像や画像所見による臨床診断であり、4例で結核菌培養陽性、3例でPCR陽性、2例は生検組織の病理所見で診断している。2例で施行されたツベルクリン反応はいずれも強陽性を示している。平成16年度の研究班調査では集めることができた症例数は少なく、結核症によるIRISの実態を十分には把握できていないかもしれないが、わが国における結核症-IRISの一端を示しているものと考える。
結核症のparadoxical IRISの発症率は、Namaleら 78によるメタ解析で18%(4~54%)と報告されている。発熱、呼吸器症状の悪化、リンパ節腫大が主な症状であり、胸部画像所見では新たな浸潤影の出現、肺門・縦隔リンパ節の腫大、胸水貯留などがみられる。また、腹腔内リンパ節腫大に伴う腹痛や黄疸、播種型に伴った急性腎障害 79などの症状が出現することもある。抗HIV治療開始からIRIS発症までの期間の中央値は、19~87日である 78と報告されている。
結核症のunmasking IRISは、抗HIV治療を開始した患者の1~4%にみられ、結核症-IRISの23~37%を占める 64と報告されている。unmasking IRISの病型はparadoxical IRISと共通しているが、播種性結核がより一般的な病型として認められ、体重減少、リンパ節腫大、髄膜症、重症肺炎、結核性膿瘍などの臨床像を呈する 80と報告されている。抗HIV治療開始からIRIS発症までの期間は、最短のものでは4日の報告例 81があり、中央値も12日であり 65、paradoxical IRIS例に比べ早期に発症する傾向がある。
中枢神経系に合併する結核症によるIRIS(CNS TB-IRIS:central nervous system tuberuculosis-IRIS)は、HIV感染者でのIRISのマネジメントにおいて重要な課題となっている。CNS TB-IRISの半数は結核性髄膜炎が占めている 82が、他には頭蓋内結核腫、脳膿瘍、脊髄硬膜外膿瘍、脊髄神経根炎などを発症している。paradoxical IRISでは、抗HIV治療開始14日後(中央値)に神経症状が再出現するが、時には3ヵ月以上経過してから発症することもある 83。頭痛、項部硬直、意識障害、新規の痙攣、麻痺、眼球運動の異常、視力低下などの症状 84が報告されている。診断にはMRIなどの画像診断法、脳脊髄液所見・抗酸菌培養・PCR検査・アデノシンデアミナーゼ(ADA)測定、生検などを利用する。画像所見は、結核腫、膿瘍、脊髄神経根炎の診断に役立つ。IRISの場合には原因病原体の同定がより困難になりやすいので、画像所見や補助診断法などを用いて臨床的診断となることもある。結核性髄膜炎を治療中のHIV感染者が抗HIV治療開始後に神経学的悪化を認めれば、CNS TB-IRISの可能性が強く疑われる。しかし、クリプトコックス髄膜炎など他の中枢神経系合併症が顕在化したり、同時に合併することがあるので、注意が必要である。
paradoxical IRISの対応は、6ヵ月以上の抗結核治療を行っていても活動性病巣が存在する場合を除けば治療薬を新たに追加する必要はなく、生命的な危険がなければ抗HIV治療も継続することが望ましい 85。IRISに対する治療のエビデンスはまだ限られているが、副腎皮質ステロイド薬が第一選択となる。プレドニゾロン1~2mg/kg/日で開始し、症状をみながら4週間以降に減量していくことが多い。Meintjesら 62は、結核症によるparadoxical IRISに副腎皮質ステロイド薬の有効性を評価し、症状・炎症性マーカー・QOLがより早期に改善し、入院期間を短縮したと報告している。しかし、副腎皮質ステロイド薬の減量中や終了後に症状が悪化する症例が存在し、その場合は投与期間を延長する必要が出てくる。Banaら 86は90日以上の症状が持続する症例を難治症例と定義し、危険因子はIRIS発症時にリンパ節病変を認めることと耐性結核であることを指摘している。
unmasking IRISの対応は、まずは標準的な抗結核治療を開始することになる。抗HIV治療は、可能な限り継続することが推奨されている 87。副腎皮質ステロイド薬の有用性については明らかになっていないが、重篤な炎症性兆候のコントロールを目的に使用する必要性が指摘されている 81。また、免疫不全が進行したHIV感染者に抗HIV治療を開始する際にイソニアジドによる結核菌の再活性を抑え、unmasking IRISを予防する試みが行われている 88。
CNS TB-IRISに対する副腎皮質ステロイド薬の有効性は、他の結核症によるIRISに比べてインパクトが限定的であるが、生命予後を改善させる可能性が指摘されている 89。また、副腎皮質ステロイド薬を使用することでは、CNS TB-IRISの発症を予防することも困難である。CNS TB-IRISの予後が不良であることも考慮し、結核性髄膜炎を発症したHIV感染者では、抗結核治療開始後8週間は抗HIV治療を導入しないことが推奨されている 90。
結核症によるparadoxical IRISを発症した症例の死亡率は、メタ解析結果では7%であるが、IRISが死因となっている症例は2%であると報告されている。しかし、CNS TB-IRISの予後は不良で、死亡率が13~30%に達し、加えて30%の症例に何らかの後遺症を認めると報告されている 82,91。
HIV感染者の抗結核治療は、薬剤の副作用が起こりやすい点以外にリファマイシン系薬剤が抗HIV薬などとの間に薬物相互作用があることから薬剤選択には注意が必要である。抗HIV治療ガイドライン 92などを参考にして治療薬を選択することが望ましい。
4)サイトメガロウイルス感染症
研究班の調査結果では、サイトメガロウイルス感染症の病型は33例中26例が眼病変であり、網膜炎だけでなく、ぶどう膜炎(IRU:immune recovery uveitis)なども認める。半数の症例では視覚障害を自覚しているが、自覚症状がないこともあり、抗HIV治療開始後にも定期的な眼科フォローが必要である。眼病変以外に、腸炎(3例)、肝炎(2例)、肺炎(2例)の病型もあり、注意が必要である(表20)。
表20:免疫再構築症候群としてのサイトメガロウイルス感染症の病型・症状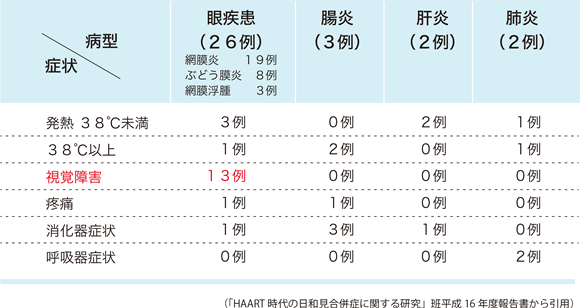
サイトメガロウイルス感染症の診断は、33例中17例で眼底所見などによる臨床診断であり、9例ではアンチゲネミアの陽性、3例では大腸などの生検組織の病理所見で診断している。サイトメガロウイルス網膜炎の眼底所見は特徴的であり、診断が可能である。アンチゲネミアは簡便な検査であり、サイトメガロウイルス感染症の診断には有用な方法であるが、サイトメガロウイルス網膜炎では陰性のこともある。サイトメガロウイルス感染症では消化管の潰瘍性病変を認めることがあり、その診断には生検が必要なことも多い。生検は潰瘍底と潰瘍辺縁で行い、生検検体が多いほど診断率が高くなる。
サイトメガロウイルス感染症によるIRISの発症率は、後方視的コホート研究で18% 2、サイトメガロウイルス網膜炎発症者のサーベイランスで17.6%である 93と報告されている。本邦では、濱本ら 94が眼科受診をしたHIV感染者261名でのIRU発症率は4例(1.5%)であるが、サイトメガロウイルス網膜炎を発症していた23例に限ると発症率は17.4%であると報告している。網膜病変が大きいことと抗HIV治療後の免疫回復が良好であることが、サイトメガロウイルス-IRISによるぶどう膜炎の発症リスクとして指摘されている 87。
IRUの治療には、軽微で経過観察ができる例を除いて副腎皮質ステロイド薬の使用が必要である。投与経路は、眼科的な局所投与と経口・点滴静注による全身投与とがある。全身的な副作用を軽減し、局所濃度を高めることができるので、局所投与が可能であればそれが望ましい 95。併せて、抗サイトメガロウイルス治療も行う必要がある 96。経口薬のバルガンシクロビルはバイオアベイラビリティが高いので、有用な薬剤である。点滴静注薬としては、ガンシクロビルが第一選択薬、ホスカルネットが第二選択薬、シドホビル(国内未承認)が第三選択薬に位置づけられている。全身投与に不寛容な場合には、ガンシクロビルの硝子体内注射や眼内インプラントが行われることもある。また、白内障、増殖性硝子体網膜症、硝子体黄斑牽引症候群などを合併した場合には、眼科的手術が必要となることもある 97。眼科疾患以外のサイトメガロウイルス感染症によるIRISへの対応に関しては、エビデンスの集積が少ないが、抗サイトメガロウイルス薬と副腎皮質ステロイド薬による治療が基本となる。
5)ニューモシスチス肺炎
ニューモシスチス肺炎の病型は、全例が肺炎である。12例で38℃以上の発熱があり、咳嗽、呼吸困難などの呼吸器症状を伴っていることが多い傾向がある。
(表21)。
表21:免疫再構築症候群としてのニューモシスチス肺炎の病型・症状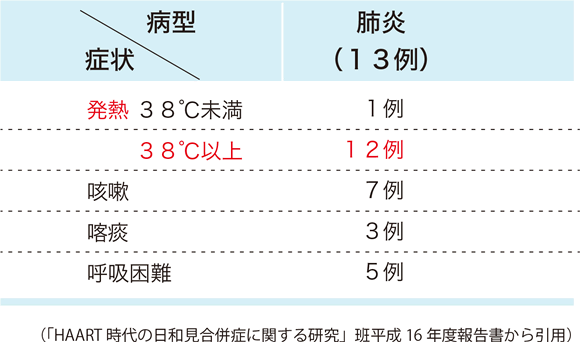
ニューモシスチス肺炎の診断は、13例中10例が臨床経過と胸部画像所見などによる臨床的診断である。気管支肺胞洗浄(BAL)を実施した症例では、1例でグロコット染色によってPneumocystis jiroveciiのシストを認め、2例でPCR法が陽性であったが、IRISでは病原体を証明できないこともある。ニューモシスチス肺炎症例では血清β-Dグルカン値は上昇することが多く、補助診断に有用である 98。しかし、ニューモシスチス肺炎によるIRISの診断での血清β-Dグルカン値の意義についてまだまとまった報告がない。ニューモシスチス肺炎の胸部CT所見は、モザイク状のスリガラス影が特徴的であるが、多彩な所見を認め 99 、IRISでは器質化肺炎の変化を示すこともある 100。
ニューモシスチス肺炎のparadoxical IRISの発症率に関するコホート研究は少ないが、Tatoら 101は123例中6例(4.9%)に発症したと報告している。また、ニューモシスチス肺炎-IRISを発症した37例の報告集計では、51%の症例が呼吸不全を発症している 101。ニューモシスチス肺炎-IRIS症例でARDSを発症した死亡例も報告されている 102。最近では、通常の人工呼吸管理では改善せず、ECMO(体外式膜型人工肺)を使用して救命し得た症例も報告されている 103。ニューモシスチス肺炎-IRISでは呼吸不全による重症化リスクがあり、重症化の危険因子を明らかにすることは今後の重要な課題である。
ニューモシスチス肺炎-IRISへの対処法は確定したものはないが、他の原因がない呼吸不全症例には副腎皮質ステロイド薬の投与が勧められている 57。IRISの場合はPneumocystis jiroveciiを検出しない場合もあるが、副腎皮質ステロイド薬を使用することからも抗ニューモシスチス薬を併用することが望ましい。スルファメトキサゾール/トリメトプリムは第一選択薬ではあるが、HIV感染者では副作用が起こりやすいので注意が必要である。ペンタミジンやアトバコンが第二選択薬として存在するが、アトバコンは中等症までのニューモシスチス肺炎が治療対象となる。
VIII.免疫再構築症候群の経過
平成16年に研究班で実施した調査では、IRISへの対応は抗微生物薬の開始・追加・変更が主体となっていたが、明らかな耐性などの問題がなければ基本的には追加や変更をする必要はない。平成16年時点では副腎皮質ステロイド薬を積極的に使用する傾向が乏しく、抗HIV治療を中断する傾向も認めている。中でも非結核性抗酸菌症は対応が難しく、抗HIV治療を13例で中断している(表22)。
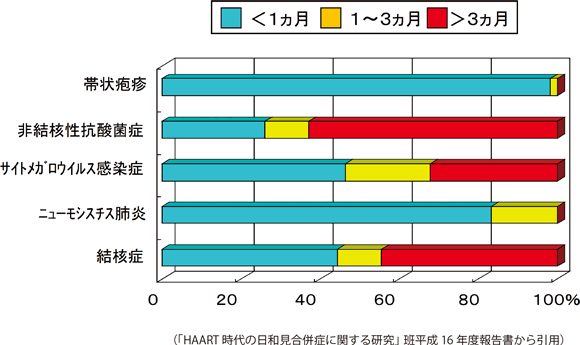
IRISの転帰は、ニューモシスチス肺炎の1例が死亡していましたが、他の症例は軽快または治癒している。しかし、IRIS治癒症例においても治癒までの期間が、非結核性抗酸菌症、サイトメガロウイルス感染症、結核症では3ヵ月以上を要した症例が多く、難渋する傾向を認めている(図14)。そのため、それらのIRISでは積極的に副腎皮質ステロイド薬を使用することが必要であると考える。
抗HIV治療を開始する前には、IRISを発症した場合の重症化リスクを評価することは重要である。たとえば、日和見感染症によるparadoxical IRISとして予後不良のリスクが高いものは、クリプトコックス髄膜炎や結核性髄膜炎などの中枢神経系感染症であり、抗HIV治療の開始時期を慎重に判断すべきである。また、中枢気道に存在するカポジ肉腫はIRISによって気道閉塞のリスクがあるので、抗がん化学療法の先行や気道確保の実施後に抗HIV治療を開始するなどの対応が必要である。
IRISは患者にとっては余分な苦痛であり、医療者にとっては治療計画の妨げとなることから、回避できるのであれば回避すべき事象ではある。ところが一方で、Parkら104は日和見感染症の発症後にIRISを発症した症例の方がIRISを発症しなかった症例に比べると、長期予後が良好であると報告しており、興味深い点である。
文献
- French MA, Mallal SA, Dawkins RL. Zidovudine-induced restoration of cell-mediated immunity to mycobacteria in immunedeficient HIV-infected patients. AIDS. 6: 1293-1297, 1992.
- French MA, Lenzo N, Mallal SA, et al. Immune restoration disease after the treatment of immunodeficient HIV-infected patients with highly active antiretroviral therapy. HIV Med. 1: 107-115, 2000.
- Dhasmana DJ, Dheda K, Ravn P, et al. Immune reconstitution inflammatory syndrome in HIV-infected patients receiving antiretroviral therapy. Drugs. 68: 191-208, 2008.
- 日本結核病学会用語委員会. 新しい結核用語辞典,2008.https://www.kekkaku.gr.jp/pubiction/
- Gupta M, Jafri K, Sharim R, et al. Immune reconstitution inflammatory syndrome associated with biologic therapy. Curr Allergy Asthma Rep. 15: 499, 2015.
- Autran B, Carcelain G, Li TS, et al. Positive effects of combined antiretroviral therapy on CD4+ T cell homeostasis and function in advanced HIV disease. Science. 277: 112-116, 1997.
- Kampmann B, Tena-Coki GN, Nicol MP, et al. Reconstitution of antimycobacterial immune responses in HIV-infected children receiving HAART. AIDS. 20: 1011-1018, 2006.
- Lawn SD, Meintjes G. Pathogenesis and prevention of immune reconstitution disease during antiretroviral therapy. Expert Rev Anti Infect Ther. 9: 415-430, 2011.
- Kitabatake M, Konishi M, Matsumura Y, et al. Establishment of immune reconstitution inflammatory syndrome (IRIS) model and critical role of CD8+ T cells in Mycobacterium avium complex infection (Abstract). The 45th Annual Meeting of the Japanese Society for Immunology, 2016.
- Shelburne SA, Montes M, Hamill RJ. Immune reconstitution inflammatory syndrome: more answers, more questions. J Antimicrob Chemother. 57: 167-170, 2006.
- Haddow LJ, Easterbrook PJ, Mosam A, et al. Defining immune reconstitution inflammatory syndrome: Evaluation of expert opinion versus 2 case definitions in a South Africa cohort. Clin Infect Dis. 49: 1424-1432, 2009.
- Suryana K. A challenge in diagnosis of tuberculosis-associated immune reconstitution inflammatory syndrome (TB-IRIS). HIV/AIDS-Research and Palliative Care. 12: 263-269, 2020.
- Walker NF, Scriven J, Meintjes G, Wilkinson RJ. Immune reconstitution inflammatory syndrome in HIV-infected patients. HIV/AIDS-Research and Palliative Care. 7: 49-64, 2015.
- Hoffmann CJ, Brown TT. Thyroid function abnormalities in HIV-infected patients. Clin Infect Dis. 47: 488-494, 2007.
- 古西 満,源河いくみ,中村哲也,ほか.免疫再構築症候群の臨床像に関する調査.厚生労働科学研究費補助金エイズ対策研究事業HAART時代の日和見合併症に関する研究平成16年度総括・分担研究報告書.84-92,2005.
- Espinosa E, Peña-Jiménez A, Ormsby CE, et al. Later onset of herpes zoster-associated immune reconstitution inflammatory syndrome. HIV Med. 10: 454-457, 2009.
- French MA, Lenzo N, John M, et.al. Immune restoration disease after the treatment of immunodeficient HIV-infected patients with highly active antiretroviral therapy. HIV Medicine. 1: 107-115, 2000.
- Müller M, Wandel S, Colubunders R, et al. Immune reconstitution inflammatory syndrome in patients starting antiretroviral therapy for HIV infection: a systematic review and meta-analysis. Lancet Infect Dis. 10: 251-261, 2010.
- Dutertre M, Cuzin L, Demonchy E, et al. Initiation of antiretroviral therapy containing integrase inhibitors increases the risk of IRIS requiring hospitalization. J Acquir Immune Defic Syndr. 76: e23-e26, 2017.
- Wijting IEA, Wit FWNM, Rokx C, et al. Immune reconstitution inflammatory syndrome in HIV infected late presenters starting integrase inhibitor containing antiretroviral therapy. EClinical Medicine 17, 2019. doi: 10.1016/j.eclinm.2019.11.003.
- Kityo C, Szubert AJ, Siika A, et al. Raltegravir-intensified initial antiretroviral therapy in advanced HIV disease in Africa: A randomized controlled trial. PLoS Med 15, 2018. doi: 10.1371/journal.pmed.1002706.
- Gaillet A, Calin R, Flandre P, et al. Increased risk of IRIS-associated tuberculosis in HIV-infected patients receiving integrase inhibitors. Infect Dis Now 51: 90-93, 2021.
- Kim J, Nam H-J, Kang S-J, et al. Integrase strand transfer inhibitor treatment does not increase the incidence of immune reconstitution inflammatory syndrome in HV-infected Koreans. HIV Med 22: 705-714, 2021.
- Zhao Y, Hohlfeld A, Namale P, et al. Risk of immune reconstitution inflammatory syndrome with integrase inhibitors versus other classes of antiretrovirals: a systematic review and meta-analysis of randomised trials. J Acquir Immune Defic Syndr 90: 232-239, 2022.
- 古西 満,照屋勝治,宇野健司,ほか.免疫再構築症候群の発症率・発症疾患に関する調査結果.第89回日本感染症学会西日本地方会学術集会・第62回日本感染症学会中日本地方会学術集会・第67回日本化学療法学会西日本支部総会プログラム・抄録集.218,2019.
- Murdoch DM, Venter WDF, Feldman C, et al. Incidence and risk factors for the immune reconstitution inflammatory syndrome in HIV patients in South Africa: a prospective study. AIDS 22: 601-610, 2008.
- Lawn SD, Bekker L-G, Miller RF. Immune reconstitution disease associated with mycobacterial infections in HIV-infected individuals receiving antiretrovirals. Lancet Infect Dis. 5: 361-373, 2005.
- 小河原光正,坂谷光則,木村 剛.日和見疾患合併HIV感染症の多剤併用療法に関する研究.厚生労働科学研究費補助金エイズ対策研究事業多剤併用療法服薬の精神的、身体的負担軽減のための研究班平成17 年度研究報告書.69-77,2006.
- Feller L, Wood NH, Lemmer J. Herpes zoster infection as an immune reconstitution inflammatory syndrome in HIV-seropositive subjects: a review. Surg Oral Med Oral Patho Oral Radiol Endod. 104: 455-460, 2007.
- 中村哲也,岡 慎一,永田洋一,蕪城俊克.CMV感染症における免疫再構築症候群の臨床的検討.厚生労働科学研究費補助金エイズ対策研究事業HAART時代の日和見合併症に関する研究平成16 年度総括・分担研究報告書.40-42,2005.
- Sungkanuparph S, Jongwutiwes U, Kiertiburanakul S. Timing of cryptococcal immune reconstitution inflammatory syndrome after antiretroviral therapy in patients with AIDS and cryptococcal meningitis. J Acquir Immune Defic Syndr. 45: 595-596, 2007.
- Miralles P, Berenguer J, Lacruz C, Cosín J, LóPez JC, Padilla B, Muñoz L, García-de-Viedma D. Inflammatory reactions in progressive multifocal leukoencephalopathy after highly active antiretroviral therapy. AIDS. 15: 1900-1902, 2001.
- 古西 満,宇野健司,菱矢直邦,ほか.一地方エイズ治療中核拠点病院における免疫再構築症候群の発症状況.日化療会誌.67(S-A)251,2019.
- Pérez-Rueda M, Hernández-Cabrera M, Francés-Urmeneta A, et al. Immune reconstitution inflammatory syndrome in HIV-infected immigrants. Am J Trop Med Hyg 97: 1072-1077, 2017.
- Thambuchetty N, Mehta K, Arumugam K, et al. The epidemiology of IRIS in Southern India: An observational cohort study. J Int Assoc Provid AIDS Care 16: 475-480, 2017.
- Lodi S, Amo J, Moreno S, et al. Opportunistic infections and AIDS malignancies early after initiating combination antiretroviral therapy in high-income countries. AIDS 28: 2461-2471, 2014.
- Sereti I, Sheikh V, Shaffer D, et al. Prospective international study of incidence and predictors of immune reconstitution inflammatory syndrome and death in people living with human immunodeficiency virus and severe lymphopenia. Clin Infect Dis 2019. Doi: 10.1093/cid/ciz877.
- Elliott HJ, Vohith K, Saramony S, et al. Immunopathogenesis and diagnosis of tuberculosis-associated immune reconstitution inflammatory syndrome during early antiretroviral therapy. J Infect Dis 200: 1736-1745, 2009.
- Jarvis JN, Lawn SD, Wood R, et al. Screening for cryptococcal antigenemia in patients accessing an antiretroviral treatment program in South Africa. Clin Infect Dis 48: 856-862, 2010.
- 照屋勝治,田沼順子,立川夏夫.HIV感染者における免疫再構築症候群(サイトメガロウイルス網膜炎)発症予防に関する研究.厚生労働科学研究費補助金エイズ対策研究事業重篤な日和見感染症の早期発見と最適治療に関する研究平成19年度総括・分担研究報告書.34-38,2008.
- Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents with HIV (米国DHHS, June. 3, 2021 updated, June. 3, 2021 review). http://clinicalinfo.hiv.gov/en/guidelines.
- Meintjes G, Stek C, Blumenthal L, et al. Prednisone for the prevention of paradoxical tuberculosis-associated IRIS. N Engl J Med. 379: 1915-1925, 2018.
- Lawn SD, Myer L, Bekker L, et al. Tuberculosis-associated immune reconstitution inflammatory disease: Incidence, risk factors and impact in an antiretroviral treatment service in South Africa. AIDS 21: 335-341, 2007.
- 照屋勝治,青木孝弘,渡辺恒二,ほか.エイズ関連日和見疾患の最適治療に関する研究.厚生労働科学研究補助金エイズ対策事業ART早期化と長期化に伴う日和見感染症への対処に関する研究平成24年度報告書.40-43,2013.
- Zolopa AR, Andersen J, Komarow L, et al. Early antiretroviral therapy reduces AIDS progression/death in individuals with acute opportunistic infections: A multicenter randomized strategy trial. PLOS ONE. 4: e5575, 2009.
- Abay SM, Deribe K, Reda AA, et al. The effect of early initiation of antiretroviral therapy in TB/HIV-coinfected patients: A systematic review and meta-analysis. J Int Assoc Provid AIDS care. 14: 560-570, 2015.
- Li L, Li J, Chai C, et al. Association of CD4 T cell count and optimal timing of antiretroviral therapy initiation with immune reconstitution inflammatory syndrome and all-cause mortality for HIV-infected adults with newly diagnosed pulmonary tuberculosis: a systematic review and meta-analysis. Int J Clin Exp Pathol 14: 670-679, 2021.
- Makadzange AT, Ndhovu CE, Takarinda K, et al. Early versus delayed initiation of antiretroviral therapy for concurrent HIV infection and cryptococcal meningitis in sub-Saharan Africa. Clin Infect Dis. 50: 1532-1538, 2010.
- Boulware DR, Meya DB, Muzoora C, et al. Timing of antiretroviral therapy after diagnosis of cryptococcal meningitis. N Engl J Med.370: 2487-2498, 2014.
- Eshun-Wilson I, Okwen MP, Richardson M, et al. Early versus delayed antiretroviral treatment in HIV-positive people with cryptococcal meningitis. Cochrane Database Syst Rev. 7: CD009012. Doi: 10. 2018.
- Schäfer G, Hoffmann C, Arasteh K, et al Immediate versus deferred antiretroviral therapy in HIV-infected patients presenting with acute AIDS-defining events (toxoplasmosis, Pneumocystis jirovecii-pneumonia): a prospective, randomized, open-label multicenter study (IDEAL-study). AIDS Res Ther 16, 2019. Doi: 10.1186/s12981-019-0250-2.
- Gandhi RT, Bedimo R, Hoy JF, et al. Antiretroviral drugs for treatment and prevention of HIV infection in adults: 2022 recommendations of the International Antiviral Society-USA Panel. JAMA. 2022; doi:10.1001/jama.2022.22246.
- Guidelines for the Prevention and Treatment of Opportunistic Infections in Adults and Adolescents with HIV (米国CDC, NIH, IDSA/HIVMA, Sep. 25, 2023 updated, Sep. 25, 2023 review). http://clinicalifo.hiv.gov/en/guidelines.
- The TEMPRANO ANRS 12136 Study Group. A trial of early antiretroviral and isoniazid preventive therapy in Africa. N Engl J Med.373: 808-822, 2015.
- The INSIGHT START Study Group. Initiation of antiretroviral therapy in early asymptomatic HIV infection. N Engl J Med.373: 795-807, 2015.
- 渡邉かおる,永井英明,河野史歩,ほか.HIV感染症合併結核患者における抗レトロウイルス療法開始時期と予後の検討.結核.92:623-628,2017.
- 照屋勝治,岡 慎一,田沼順子,ほか.HIV感染者における免疫再構築症候群(サイトメガロウイルス網膜炎)発症予防に関する研究.厚生労働科学研究費補助金エイズ対策研究事業重篤な日和見感染症の早期発見と最適治療に関する研究平成20 年度総括・分担研究報告書.34-39,2009.
- Tan K, Roda R, Ostrow L, et al. PML-IRIS in patients with HIV infection: Clinical manifestations and treatment with steroids. Neurology. 72: 1458-1464, 2009.
- Kato H, Yanagisawa N, Morioka H, et al. Laryngeal Kaposi sarcoma complicated by the immune reconstitution inflammatory syndrome in an HIV-infected patient. Intern Med. 55: 1001-1005, 2016.
- Stoll M, Schmidt RE. Immune restoration inflammatory syndromes: The dark side of successful antiretroviral treatment. Curr Infect Dis Rep. 5: 266-276, 2003.
- Hirsch HH, Kaufmann G, Sendi P, et al. Immune reconstitution in HIV-infected patients. Clin Infect Dis. 38: 1159-1166, 2004.
- Meintjes G, Wilkinson RJ, Morroni C, et al. Randomized placebo-controlled trial of prednisone for paradoxical tuberculosis-associated immune reconstitution inflammatory syndrome. AIDS. 24: 2381-2390, 2010.
- Murthy AR, Marulappa R, Hegde U, et al. Treatment guidelines and prognosis of immune reconstitution inflammatory syndrome patients: A review. J Int Oral Health. 7: 92-95, 2015.
- Quinn CM, Poplin V, Kasibante J, et al. Tuberuculosis IRIS: Pathogenesis, presentation, and management across the spectrum of disease. Life 10, 0262; doi: 10.3390/life10110262.
- Haddow LJ, Moosa M-YS, Mosam A, Moodley P, Parboosing R, Easterbrook PJ. Incidence, clinical spectrum, risk factors and impact of HIV-associated immune reconstitution inflammatory syndrome in South Africa. PLoS ONE. 12 Nov 2012. doi: org/10.1371/journal.pone.0040623.
- Grabar S, Tattevin P, Selinger-Leneman H, et al. Incidence of herpes zoster in HIV-infected adults in the combined antiretroviral therapy era: Results from the FHDH-ANRS CO4 cohort. Clin Infect Dis. 60: 1269-1277, 2015.
- Hosoda T, Uehara Y, Kasuga T, et al. An HIV-infected patient with acute retinal necrosis as immune reconstitution inflammatory syndrome due to varicella-zoster virus. AIDS. 34: 795-796, 2020.
- 関谷綾子,城川泰司郎,宮下竜伊,ほか.水痘・帯状疱疹ウイルスによる免疫再構築症候群で多発脳神経麻痺を来したHIV感染者の1例.感染症誌.93:775-779,2019.
- Teo SY, Raha D, Warren D, et al. Central nervous system-immune reconstitution inflammatory syndrome presenting as varicella zoster virus-mediated vasculitis causing stroke. Int J STD AIDS. 25: 683-685, 2014.
- Murdoch DM, Venter WDF, Rie AV, et al. Immune reconstitution inflammatory syndrome (IRIS): Review of common infectious manifestations and treatment options. AIDS Res Ther. May 8; 4:9. doi: 10.1186/1742-6405-4-9, 2007.
- Teruya H, Tateyama M, Hibiya K, et al. Pulmonary Mycobacterium parascrofulaceum infection as an immune reconstitution inflammatory syndrome in an AIDS patient. Intern Med. 49: 1817-1821, 2010.
- Leth S, Jensen-Fangel S. Infrapatellar bursitis with Mycobacterium malmoense related to immune reconstitution inflammatory syndrome in an HIV-positive patient. BMJ Case Rep. 2012 Nov 27; bcr2012007459. doi: 10.1136/bcr-2012-007459, 2012.
- 北田清悟.抗GPL-core IgA抗体検査用キット「キャピリアMAC抗体ELISA」.臨床と微生物.43(増刊):609-612,2016.
- 宇野健司,善本英一郎,古西 満.免疫再構築症候群に関する情報収集と提供.厚生労働省科学研究エイズ対策事業「日和見感染症の診断/治療およびそれを端緒とするHIV感染者の早期発見に関する研究」平成22年度報告書.54-63,2011.
- Riddell J Ⅳ, Kaul DR, Karakousis PC, et al. Mycobacterium avium complex immune reconstitution inflammatory syndrome: Long term outcomes. J Transl Med. Oct 15; 5: 50. doi: 10.1186/1479-5876-5-50, 2007.
- Breglio KF, Vinhaes CL, Arriaga MB, et al. Clinical and immunologic predictors of Mycobacterium avium complex immune reconstitution inflammatory syndrome in a contemporary cohort of patients with HIV. J Infect Dis Oct 26; jiaa669. doi: 1093/infdis/jiaa669, 2020.
- 永井英明.HIV感染症と非結核性抗酸菌症.化学療法の領域.32:1521-1525,2016.
- Namale PE, Abdullahi LH, Fine S, et al. Paradoxical TB-IRIS in HIV-infected adults: A systematic review and meta-analysis. Future Microbiol. 10: 1077-1099, 2015.
- Jehle AW, Khanna N, Sigle JP, et al. Acute renal failure on immune reconstitution in an HIV-positive patient with milliary tuberculosis. Clin Infect Dis. 38: e32-35, 2004.
- Worodria W, Massinga-Loembe M, Mayanja-Kizza H, et al. Antiretroviral treatment-associated tuberculosis in a prospective cohort of HIV-infected patients starting ART. Clin Dev Immunol. 2011:758350. doi: 10.1155/2011/758350, 2011.
- Valin N, Pacanowski J, Denoeud L, et al. Risk factors for “unmasking immune reconstitution inflammatory syndrome” presentation of tuberculosis following combination antiretroviral therapy initiation in HIV-infected patients. AIDS. 24: 1519-1525, 2010.
- Tӧrӧk ME, Yen NTB, Chau TTH, et al. Timing of initiation of antiretroviral therapy in human immunodeficiency virus (HIV)-associated tuberculous meningitis. Clin Infect Dis. 52: 1374-1383, 2011.
- Bahr N, Boulware DR, Marais S, et al. Central nervous system immune reconstitution inflammatory syndrome. Curr Infect Dis Rep. 15: 2013 December; doi: 10.1007/s11908-013-0378-5, 2013.
- Quinn CM, Poplin V, Kasibante J, et al. Tuberculosis IRIS: Pathogenesis, presentation, and management across the spectrum of disease. Life 2020, 10, 0262; doi: 10.3390/life10110262, 2020.
- Meintjes G, Brust JCM, Nuttall J, et al. Management of active tuberculosis in adults with HIV. Lancet HIV. 6: e463-474, 2019.
- Bana TM, Lesosky M, Pepper DJ, et al. Prolonged tuberculosis-associated immune reconstitution inflammatory syndrome: Characteristics and risk factors. BMC Infect Dis. 16:518; ddoi: 10.1186/s12879-016-1850-2, 2016.
- Walker NF, Stek C, Wasserman S, et al. The tuberculosis-associated immune reconstitution inflammatory syndrome: Recent advances in clinical and pathogenesis research. Curr Opin HIV AIDS. 13: 512-521, 2018.
- Dorovni B, Cavalcante S. Preventive therapy for HIV-associated tuberculosis. Curr Opin HIV AIDS. 13: 507-511, 2018.
- Prasad K, Singh MB, Ryan H. Corticosteroids for managing tuberculous meningitis. Cochrane Database Syst Rev. 2016 Apr 28; 4(4):CD002244. Ddoi: 10.1002/14651858. CD002244.pub4, 2016.
- Nahid P, Dorman SE, Alipanah N, et al. Official American Thoracic Society/Center for Disease Control and Prevention/Infectious Diseases Society of American Clinical Practice Guidelines: Treatment of drug-susceptible tuberculosis. Clin Infect Dis. 63: e147-195, 2016.ŁŁ
- Pepper DJ, Marais s, Maartens G, et al. Neurologic manifestations of paradoxical tuberculosis-associated immune reconstitution inflammatory syndrome: A case series. Clin Infect Dis. 48: e96-107, 2009.
- HIV感染症及びその合併症の課題を克服する研究班.抗HIV治療ガイドライン.2020年3月.
- Kempen JH, Min YI, Freeman WR, et al. Risk of immune recovery uveitis in patients with AIDS and cytomegalovirus retinitis. Ophthalmol. 113: 684-694, 2006.
- 濱本亜裕美,建林美佐子,上平朝子,ほか.ヒト免疫不全ウイルス(HIV)患者のHAART導入前後の眼合併症.日眼会誌.116:721-729,2012.
- Jabs DA, Ahuja A, van Natta M, et al. Course of cytomegalovirus retinitis in the era of highly active antiretroviral therapy: Five-year outcomes. Ophthalmol. 117: 2152-2161, 2010.
- Nguyen QD, Kempen JH, Bolton SG, et al. Immune recovery uveitis in patients with AIDS and cytomegalovirus retinitis after highly active antiretroviral therapy. Am J Ophthalmol. 129: 634-639, 2000.
- Urban B, Bakunowicz-Łazarczyk A, Michalczuk M. Immune recovery uveitis: Pathogenesis, clinical symptoms, and treatment. Mediators Inflamm. 2014;971417. Ddoi: 10.1155/2014/971417, 2014.
- White PL, Backx M, Barnes RA. Diagnosis and management of Pneumocystis jirovecii infection. Expert Rev Anti Infect Ther. 15: 435-447, 2017.
- Taeb AM, Sill JM, Derber CJ, et al. Nodular granulomatous Pneumocystis jiroveci pneumonia consequent to delayed immune reconstitution inflammatory syndrome. Int J STD AIDS. 29: 1451-1453, 2018.
- Godoy MCB, Silva CIS, Ellis J, et al. Organizing pneumonia as a manifestation of Pneumocystis jiroveci immune reconstitution syndrome in HIV-positive patients: Report of 2 cases. J Thorac Imaging. 23: 39-43, 2008.
- Tato LR, Cibrian JB, Fábregas AC, et al. Immune reconstitution inflammatory syndrome in HIV-infected patients with Pneumocystis jirovecii pneumonia. Enferm Infect Microbiol Clin. 36: 621-625, 2018.
- Cawcutt K, Gallo De Moraes A, Wolock TM, et al. The use of ECMO in HIV/AIDS with Pneumocystis jirovecii pneumonia: A case report and review of the literature. ASAIO J. 60: 606-608, 2014.
- Ramanathan K, Svasti JK, MacLaren G. Extracorporeal life support for immune reconstitution inflammatory syndrome in patients with Pneumocystis jirovecii pneumonia. J Artif Organs. 21: 371-373, 2018.
- Park WB, Choe PG, Jo JH, et al. Immune reconstitution inflammatory syndrome in the first year after HAART: influence on long-term clinical outcome. AIDS. 20: 2390-2392, 2006.
国立研究開発法人日本医療研究開発機構(AMED) エイズ対策実用化研究事業
「AR 早期化と長期化に伴う日和見感染症への対処に関する研究 」
研究開発代表者
国立国際医療研究センター エイズ治療 ・研究開発センター 照屋 勝治
研究開発分担者
長崎大学大学院医歯薬学総合研究科 臨床感染症学分野 泉川 公一
国立感染症研究所 感染病理部 片野 晴隆
国立病院機構東京病院 臨床研究部 永井 英明
国立病院機構九州医療センター 免疫感染症内科 高濱 宗一郎
奈良県立医科大学 健康管理センター 古西 満
免疫再構築症候群 診療のポイント Ver.6
発行: 2023年12月
発行責任:古西 満(奈良県立医科大学健康管理センター)
デザイン 印刷:木村アートプランニング